Giải bài tập hóa học lớp 11 kết nối tri thức bài 2 Cân bằng trong dung dịch nước
Giải bài tập hóa học lớp 11: Cân bằng trong dung dịch nước
Trang sách "Hóa học lớp 11 Kết nối tri thức" cung cấp phần đáp án chuẩn và hướng dẫn giải chi tiết cho các bài tập về cân bằng trong dung dịch nước. Đây là một phần quan trọng trong chương trình học, giúp học sinh hiểu rõ về quy luật cân bằng hóa học trong các dung dịch. Mong rằng, thông qua việc nắm vững kiến thức này, các em học sinh sẽ có thể áp dụng vào thực hành và nắm vững kiến thức hóa học.
Bài tập và hướng dẫn giải
MỞ ĐẦU
Hình 2.1 cho thấy giá trị pH của dung dịch một số chất thông dụng. Vậy pH là gì? pH có ảnh hưởng gì đến đời sống? Xác định pH như thế nào?

I. SỰ ĐIỆN LI
1. Hiện tượng điện li
Hoạt động nghiên cứu: Tìm hiểu về sự điện li.
Thí nghiệm thử tính dẫn điện của nước, muối ăn và dung dịch muối ăn được thực hiện như mô tả của trong Hình 2.2.
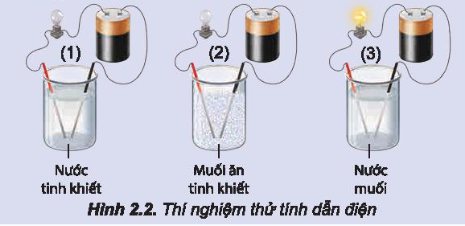
Thực hiện yêu cầu:
a) Nhắc lại khái niệm dòng điện.
b) Đèn sáng cho thấy dung dịch NaCl dẫn điện, chứng tỏ trong dung dịch có hạt mang điện. Đó có thể là loại hạt nào (electron, phân tử NaCl, cation hay anion).
c) Hãy giải thích sự tạo thành hạt mang điện đó.
2. Chất điện li
Hoạt động nghiên cứu: Tìm hiểu về chất điện Ii và chất không điện li
Kết quả thử tính dẫn điện với các dung dịch hydrochloric acid (HCI), sodium hydroxide (NaOH), saccharose (C12H22O11), ethanol (C2H5OH) được trình bày trong bảng dưới đây. Hãy hoàn thành các thông tin còn thiếu trong bằng vào vở.
| Dung dịch HCl | Dung dịch NaOH | Dung dịch saccharose | Dung dịch ethanol | |
| Hiện tượng | Đèn sáng | Đèn sáng | Đèn không sáng | Đèn không sáng |
| Dung dịch dẫn điện/ không dẫn điện | ? | ? | ? | ? |
| Có/không có các ion trái dấu trong dung dịch | ? | ? | ? | ? |
| Chất điện li/chất không điện li | ? | ? | ? | ? |
Hoạt động nghiên cứu: So sánh khả năng phân li trong nước của HCl và CH3COOH
Kết quả thử tính dẫn điện với dung dịch HCl 0,1 M và dung dịch CH3COOH 0,1 M cho thấy trường hợp cốc đựng dung dịch HCl 0,1 M bóng đèn sáng hơn.
Thực hiện yêu cầu sau:
Hãy so sánh số ion mang điện trong hai dung dịch trên, từ đó cho biết acid nào phân li mạnh hơn.
Câu hỏi 1: Viết phương trình điện li của các chất sau: HF, HI, Ba(OH)2, KNO3, Na2SO4.
II. THUYẾT ACID-BASE CỦA BRONSTED - LOWRY
1. Khái niệm acid và base theo thuyết Bronsted - Lowry
Hoạt động nghiên cứu: Cho các dung dịch HCl, NaOH, Na2CO3.
a) Viết phương trình điện li của các chất trên.
b) Sử dụng máy đo pH (hoặc giấy pH) xác định pH, môi trường (acid/base) của các dung dịch trên.
c) Theo khái niệm acid - base trong môn khoa học tự nhiên ở lớp 8, trong những chất cho ở trên: Chất nào là acid? Chất nào là base?
Câu hỏi 2: Dựa vào thuyết acid - base của Bronsted - Lowry, hãy xác định chất nào là acid, chất nào là base trong các phản ứng sau:
a) CH3COOH + H2O $\rightleftharpoons $ CH3COO$^{-}$ + H3O$^{+}$
b) S$^{2-}$ + H2O $\rightleftharpoons $ HS$^{-}$ + OH$^{-}$
2. Ưu điểm của thuyết Bronsted - Lowry
III. KHÁI NIỆM pH VÀ Ý NGHĨA CỦA pH TRONG THỰC TIỄN
1. Khái niệm pH
Câu hỏi 3: Một loại dầu gội đầu có nồng độ ion OH$^{-}$ là 10$^{-5,17}$ mol/L.
a) Tính nồng độ ion H$^{+}$, pH của loại dầu gội nói trên.
b) Môi trường của loại dầu gội nói trên là acid, base hay trung tính?
Câu hỏi 4: Một học sinh làm thí nghiệm xác định độ pH của đất như sau: Lấy một lượng đất cho vào nước vừa lọc lấy phần dung dịch dùng máy pH đo được giá trị pH là 4,52.
a) Hãy cho biết môi trường của dung dịch là acid, base hay trung tính.
b) Loại đất trên được gọi là đất chua. Hãy đề xuất biện pháp để giảm độ chua tăng độ pH của đất.
Câu hỏi 5: pH của dung dịch nào sau đây có giá trị nhỏ nhất?
A. Dung dịch HCl 0,1M.
B. Dung dịch CH3COOH 0,1M.
C. Dung dịch NaCl 0,1M.
D. Dung dịch NaOH 0,1M.
2. Ý nghĩa của pH trong thực tiễn
Câu hỏi 6: Đo pH của một cốc nước chanh được giá trị pH bằng 2,4. Nhận định nào sau đây không đúng?
A. Nước chanh có môi trường acid.
B. Nồng độ ion [H$^{+}$] của nước chanh là 10$^{-2,4}$ mol/L.
C. Nồng độ ion [H$^{+}$] của nước chanh là 0,24 mol/L.
D. Nồng độ ion [OH$^{-}$] của nước chanh nhỏ hơn 10$^{-7}$ mol/L.
Câu hỏi 7: Nước Javel (chứa NaClO và Nacl) được dùng làm chất tẩy rửa, khử trùng. Trong dung dịch, ion ClO$^{-}$ nhận proton của nước để tạo thành HClO.
a) Viết phương trình hóa học của phản ứng xảy ra và xác định chất nào là acid, chất nào là base trong phản ứng trên.
b) Dựa vào phản ứng, hãy cho biết môi trường của nước Javel là acid hay base.
4. Xác định pH
Hoạt động nghiên cứu: Làm chất chỉ thị màu từ hoa đậu biếc/bắp cải tím
Hoàn thành thông tin theo mẫu bảng sau vào vở:
| Giấm ăn | Nước C sủi | Nước rửa bát | Nước soda | Nước muối | |
| pH | ? | ? | ? | ? | ? |
| Màu của chất chỉ thị | ? | ? | ? | ? | ? |
| Môi trường acid/base | ? | ? | ? | ? | ? |
IV. SỰ THỦY PHÂN CỦA CÁC ION
Hoạt động nghiên cứu: Cho các dung dịch sau: Na2CO3, AlCl3, FeCl3.
1. Dùng giấy pH xác định giá trị pH gần đúng của các dung dịch trên.
2. Nhận xét và giải thích về môi trường của các dung dịch trên.
V. CHUẨN ĐỘ ACID - BASE
Câu hỏi 8: Nêu một số điểm cần chú ý trong quá trình chuẩn độ.
Câu hỏi 9: Nêu một số nguyên nhân có thể dẫn đến sai số trong quá trình chuẩn độ.





