Giải bài tập sách bài tập (SBT) Hoá hoá 10 Cánh diều bài 18 Hydrogen Halide và Hydrohalic Acid
Hướng dẫn giải bài 18: Hydrogen Halide và Hydrohalic Acid
Trong bài tập này, chúng ta sẽ tìm hiểu về Hydrogen Halide và Hydrohalic Acid. Đây là một phần trong sách bài tập Hoá học 10 theo chương trình đổi mới của Bộ giáo dục. Bài tập này sẽ giúp học sinh hiểu rõ hơn về các khái niệm này và áp dụng chúng vào thực tế.
Việc học và giải bài tập trong sách bài tập "Cánh diều" sẽ giúp học sinh nắm vững kiến thức và rèn luyện kỹ năng giải quyết vấn đề. Cách hướng dẫn cụ thể và giải chi tiết sẽ giúp học sinh dễ dàng tiếp cận và hiểu bài học hơn.
Hy vọng rằng, thông qua việc giải bài tập này, học sinh sẽ có cái nhìn tổng quan về chủ đề Hydrogen Halide và Hydrohalic Acid và có thêm động lực học tập và khám phá về môn học Hoá học.
Bài tập và hướng dẫn giải
18.1. Những phát biểu nào dưới đây là đúng khi nói về các hydrogen halide HX?
A. Ở điều kiện thường, đều là chất khí.
B. Các phân tử đều phân cực.
C. Nhiệt độ sôi tăng từ hydrogen chloride đến hydrogen iodide, phù hợp với xu hướng tăng tương tác van der Waals từ hydrogen chloride đến hydrogen iodide.
D. Đều tan tốt trong nước, tạo các dung dịch hydrohalic acid tương ứng.
E. Năng lượng liên kết tăng dần từ HF đến HI.
18.2. Ở cùng điều kiện áp suất, hydrogen fluoride (HF) có nhiệt độ sôi cao vượt trội so với các hydrogen halide còn lại là do
A. fluorine có nguyên tử khối nhỏ nhất.
B. năng lượng liên kết H – F bền vững làm cho HF khó bay hơi.
C. các nhóm phân tử HF được tạo thành do có liên kết hydrogen giữa các phân tử.
D. fluorine là phi kim mạnh nhất.
18.3. Những phát biểu nào dưới đây là không đúng khi nói về các hydrohalic acid?
A. Đều là các acid mạnh.
B. Độ mạnh của acid tăng từ hydrofluoric acid đến hydroiodic acid, phù hợp xu hướng giảm độ bền liên kết từ HF đến HI.
C. Hoà tan được các oxide của kim loại, phản ứng được với các hydroxide kim loại.
D. Hoà tan được tất cả các kim loại.
E. Tạo môi trường có pH lớn hơn 7.
18.4. Những phát biểu nào sau đây là đúng khi nói về ion halide X-?
A. Dùng dung dịch silver nitrate sẽ phân biệt được các ion F-, Cl-, Br-, I-.
B. Với sulfuric acid đặc, các ion Cl-, Br-, I- thể hiện tính khử, ion F- không thể hiện tính khử.
C. Tính khử của các ion halide tăng theo dãy: Cl-, Br-, I-.
D. Ion Cl- kết hợp ion Ag+ tạo AgCl là chất không tan, màu vàng.
18.5. Những phát biểu nào sau đây là không đúng khi nói về ứng dụng hiện nay của một số hydrogen halide và hydrohalic acid?
A. Hằng năm, cần hàng chục triệu tấn hydrogen chloride để sản xuất hydrochloric acid.
B. Lượng lớn hydrochloric acid sử dụng trong sản xuất nhựa, phân bón, thuốc nhuộm,...
C. Hydrochloric acid được sử dụng cho quá trình thuỷ phân các chất trong sản xuất, chế biến thực phẩm.
D. Hydrofluoric acid hoặc hydrogen fluoride phản ứng với chlorine dùng để sản xuất fluorine.
E. Trong công nghiệp, hydrofluoric acid dùng tẩy rửa các oxide của sắt trên bề mặt của thép.
G. Hydrogen fluoride được dùng để sản xuất chất làm lạnh hydrochlorofluorocarbon HCFC (thay thế chất CFC), chất chảy cryolite, …
18.6. Những tính chất nào dưới đây thể hiện tính acid của hydrochloric acid?
A. Phản ứng với các hydroxide.
B. Hoà tan các oxide của kim loại.
C. Hoà tan một số kim loại.
D. Phản ứng với phi kim.
E. Làm quỳ tím hóa đỏ và tạo môi trường pH > 7.
G. Phân li ra ion H+.
H. Khi phản ứng với kim loại thì tạo ra muối và khí hydrogen.
18.7. Nối mỗi chất trong cột A với tính chất tương ứng của chúng trong cột B cho phù hợp.
| Cột A | Cột B |
| a) Hydrogen fluoride | 1. Là chất khí ở điều kiện thường. |
| b) Hydrofluoric acid | 2. Các phân tử tạo liên kết hydrogen với nhau. |
| c) Hydrogen chloride | 3. Có nhiệt độ sôi cao nhất trong dãy hydrogen halide. |
| d) Hydrochloric acid | 4. Là acid mạnh. |
| 5. Ăn mòn thuỷ tỉnh. | |
| 6. Thường được dùng đề thuỷ phân các chất trong quá trình sản xuất. | |
| 7. Hoà tan calcium carbonate có trong đá vôi, magnesium hydroxide, copper(II) oxide. |
18.8. Những phát biểu nào sau đây là đúng?
A. Khi cho potassium bromide rắn phản ứng với sulfuric acid đặc thu được khí hydrogen bromide.
B. Hydrofluoric acid không nguy hiểm vì nó là một acid yếu.
C. Trong phản ứng điều chế nước Javel bằng chlorine và sodium hydroxide, chlorine vừa đóng vai trò chất oxi hoá, vừa đóng vai trò chất khử.
D. Fluorine có số oxi hoá bằng -1 trong các hợp chất.
E. Tất cả các muối halide của bạc (AgF, AgCl, AgBr, AgI) đều là những chất không tan trong nước ở nhiệt độ thường.
G. Ở cùng điều kiện áp suất, hydrogen fluoride (HF) có nhiệt độ sôi cao nhất trong các hydrogen halide là do liên kết H – F bền nhất trong các liên kết H – X.
18.9. Các phân tử HX đều phân cực, nhưng chỉ có các phân tử HF tạo được liên kết hydrogen với nhau. Giải thích.
18.10. Hãy đề xuất cách phân biệt bốn dung dịch hydrohalic acid bằng phương pháp hóa học.
18.11. Hoàn thành phương trình hóa học của mỗi phản ứng sau:
a) HCl(aq) + KMnO4(s) → KCl(aq) + MnCl2(aq) + Cl2(g) + H2O(l)
b) MnO2(s) + HCl(aq) → MnCl2(aq) + ? + H2O(l)
c) Cl2(g) + ? → ? + NaClO3(aq) + H2O(l)
d) NaBr(s) + H2SO4(l) → NaHSO4(s) + ? + SO2(g) + H2O(g)
e) HI(g) + ? → I2(g) + H2S(g) + H2O(l).
18.12. Điền vào chỗ trống tên gọi hoặc công thức phân tử của các chất tương ứng:
a) …….: HI b) …….: NaCl
c) Potassium iodide: …… d) …….: NaClO
18.13. a) X là các nguyên tố bền thuộc nhóm halogen. Hãy điền công thức hóa học của nguyên tố, chất, ion theo thứ tự với các tính chất tương ứng theo bảng sau:
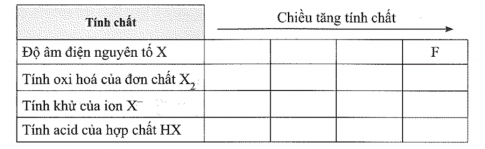
b) Viết các phản ứng chứng minh sự thay đổi tính khử của các ion X- theo xu hướng trong bảng tuần hoàn đã được hoàn thành ở câu a.
c) Tìm hiểu và giải thích vì sao tính acid của các hợp chất HX lại được thay đổi theo thứ tự như câu a.
18.14. Mỗi năm, hàng triệu tấn hydrochloric acid được cho phản ứng với acetylene (hay ethyne) và ammonia.
a) Viết phương trình hóa học của hai phản ứng trên.
b) Hai phản ứng trên được dùng trong lĩnh vực sản xuất nào?
18.15. Một trong những ứng dụng quan trọng của hydrochloric acid là dùng để loại bỏ gỉ thép trước khi đem cán, mạ điện, … Theo đó, thép sẽ được ngâm trong hydrochloric acid nồng độ khoảng 18% theo khối lượng. Các oxide tạo lớp gỉ trên bề mặt của thép, chủ yếu là các oxide của sắt và một phần sắt sẽ bị hòa tan bởi acid. Quá trình này thu được dung dịch (gọi là dung dịch A), chủ yếu chứa hydrochloric acid dư và iron(II) chloride được tạo ra từ phản ứng sắt khử ion Fe3+.
a) Viết phương trình hóa học của các phản ứng diễn ra. Các phản ứng này có phát thải khí độc vào môi trường không?
b) Để tái sử dụng acid, dung dịch A được đưa đến thiết bị phun, ở khoảng 180 oC để thực hiện phản ứng:
4FeCl2 + 4H2O + O2 → 8HCl + 2Fe2O3
Sau quá trình trên, cần làm thế nào để thu được hydrochloric acid?
18.16. Xét phản ứng sau:
4HI(aq) + O2(g) → 2H2O(l) + 2I2(s)
Cho giá trị enthalpy tạo thành chuẩn (kJ mol-1) của một số chất trong bảng dưới đây:
| HI (aq) | H2O (l) | O2 (g) | I2 (s) |
| -55 | -285 | ? | ? |
a) Điền giá trị phù hợp vào ô còn trống.
b) Xác định biến thiên enthalpy chuẩn của phản ứng trên.
c) Nếu chỉ dựa vào giá trị biến thiên enthalpy chuẩn thì phản ứng trên có thuận lợi về mặt năng lượng không? Từ đó, hãy dự đoán hiện tượng xảy ra khi dung dịch hydroiodic acid tiếp xúc với không khí.
d) Thực tế, người ta phải chứa hydroiodic acid trong chai, lọ được đậy kín. Hãy giải thích.
18.17. Trong phòng thí nghiệm, hydrochloric acid đặc có thể được dùng để điều chế khí chlorine theo hai phản ứng sau:
16HCl(aq) + 2KMnO4 (s) → 2MnCl2(aq) + 2KCl(aq) + 8H2O(l) + 5Cl2(g) (1)
4HCl(aq) + MnO2(s) → MnCl2(aq) + 2H2O(l) + Cl2 (g) (2)
Cho bảng giá trị enthalpy tạo thành chuẩn (kJ mol-1) của các chất như dưới đây:
HCl(aq) | KMnO4(s) | MnO2(s) | MnCl2(aq) | KCl(aq) | H2O(l) |
-167 | -837 | -520 | -555 | -419 | -285 |
a) Hãy tính biến thiên enthalpy chuẩn của mỗi phản ứng.
b) Thực tế, không cần đun nóng, hai phản ứng trên vẫn diễn ra ở nhiệt độ phòng. Vậy phản ứng trên đã có thể thu nhiệt từ đâu?





