CHƯƠNG 1: CẤU TẠO NGUYÊN TỬ
CHƯƠNG 2: BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC
CHƯƠNG 3: LIÊN KẾT HÓA HỌC
CHƯƠNG 4: PHẢN ỨNG OXI HÓA-KHỬ
CHƯƠNG 5: NĂNG LƯỢNG HÓA HỌC
CHƯƠNG 6: TỐC ĐỘ PHẢN ỨNG HÓA HỌC
CHƯƠNG 7: NGUYÊN TỐ NHÓM VIIA- HALOGEN
Giải bài tập 4 Cấu trúc lớp vỏ electron của nguyên tử
https://s.shopee.vn/AKN2JyAJAw
Đánh giá mô hình cấu trúc lớp vỏ electron của nguyên tử
Mô hình cấu trúc lớp vỏ electron của nguyên tử trong sách hóa học lớp 10 chân trời sáng tạo bao gồm nhiều bài tập để giải quyết. Trong đó, câu 1 đưa ra bài toán so sánh giữa mô hình của Rutherford - Bohr và mô hình hiện đại về sự chuyển động của electron trong nguyên tử.
Theo nội dung sách, điểm giống nhau giữa hai mô hình là electron chuyển động quanh hạt nhân. Tuy nhiên, điểm khác biệt là mô hình Rutherford - Bohr mô tả hạt nhân nằm ở giữa, electron chuyển động quanh hạt nhân trên quỹ đạo cố định, trong khi mô hình hiện đại không xác định được quỹ đạo, chỉ biết electron chuyển động hỗn loạn trong không gian gọi là Orbital nguyên tử.
Đánh giá về mô hình cấu trúc lớp vỏ electron của nguyên tử trong sách giáo khoa cung cấp hướng dẫn giải chi tiết, giúp học sinh hiểu rõ và nắm vững kiến thức của bài học. Qua đó, các em có cơ hội áp dụng kiến thức này vào thực tiễn và phát triển khả năng tư duy, phân tích.
Bài tập và hướng dẫn giải
Câu hỏi bổ sung
Hệ Mặt Trời hôm Mặt Trời ở trung tâm và các thiên thể quay quanh theo những quỹ đạo xác định. Hãy cho biết mô hình nguyên tử của nhà khoa học nào được gọi là mô hình nguyên tử, tương tự như hệ Mặt Trời?
Câu 2: Quan sát Hình 4.3, phân biết khái niệm đám mây electron và khái niệm orbital nguyên tử

Câu 3: Cho biết khái niệm orbital nguyên tử xuất phát từ mô hình nguyên tử của Rutherford - Bohr hay mô hình nguyên tử hiện đại
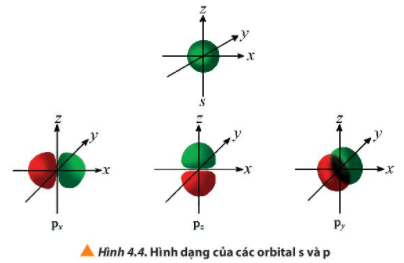
Câu 4. Quan sát Hình 4.4, hãy cho biết điểm giống và khác nhau giữa các orbital p (px, py, pz)
II. Lớp và phân lớp electron

Câu 5: Quan sát hình 4.5, nhận xét cách gọi tên các lớp electron bằng các chữ cái tương ứng với các lớp từ 1 đến 7
Câu 6: Từ hình 4.5, cho biết lực hút của hạt nhân với electron ở lớp nào là lớn nhất và lớp nào là nhỏ nhất
Câu 7: Quan sát Hình 4.6, nhận xét về số lượng phân lớp trong các lớp từ 1 đến 4
III. Cấu hình electron nguyên tử
Câu 8: Quan sát Hình 4.7, nhận xét chiều tăng năng lượng của các electron trên các A0 ở trạng thái cơ bản (trạng thái có năng lượng thấp nhất)
Câu 9: Quan sát Hình 4.8, cho biết cách biểu diễn 2 electron trong một orbital dựa trên cơ sở nào?
Câu 10: Quan sát Hình 4.9, hãy cho biết nguyên tử oxygen có bao nhiêu electron ghép đôi vào bao nhiêu electron độc thân?
Câu 11: Từ Bảng 4.1, hãy chỉ ra mối quan hệ giữa số thứ tự lớp và số electron tối đa trong mỗi lớp.
Câu hỏi bổ sung 1 :
Nguyên tử nitrogen có 2 lớp electron trong đó có 2 phân lớp s và 1 phân lớp p. Các phân lớp s đều chứa số electron tối đa, còn phân lớp p chỉ chứa một nửa số electron tối đa. Nguyên tử nitrogen có bao nhiêu electron?
Câu 12: Quan sát Hình 4.10, hãy nhận xét số lượng electron độc thân ở mỗi trường hợp
Câu 13: Hãy đề nghị cách phân bố electron vào các orbial để số electron độc thân là tối đa
Câu hỏi bổ sung 2
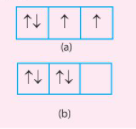
Trong các trường hợp (a) và (b) dưới đây, trường hợp nào có sự phân bố electron vào các orbital tuân theo và không tuân theo quy tắc Hund.
Câu 14: Cấu hình electron của một nguyên tử cho biết những thông tin gì?
Câu hỏi bổ sung 3
Viết cấu hình electron nguyên tử của nguyên tố aluminium (Z = 13) và biểu diễn cấu hình electron của aluminium theo ô orbital. Từ đó, xác định số electron độc thân của nguyên tử này.
Câu 15: Quan sát Bảng 4.2, hãy cho biết dựa trên cơ sở nào để dự đoán phosphorus là nguyên tố phi kim
Câu hỏi bổ sung 3
Lithium là một nguyên tố có nhiều công dụng, được sử dụng trong chế tạo máy bay và trong một số loại pin nhất định. Pin Lithium - Ion (pin Li - Ion) đang ngày càng phổ biến, nó cung cấp năng lượng cho cuộc sống của hàng triệu người mỗi ngày thông qua các thiết bị như máy tính xách tay, điện thoại di động, xe Hybrid, xe điện, ... nhờ trọng lượng nhẹ, cung cấp năng lượng cao và khả năng sạc lại. Dựa vào cấu hình electron nguyên tử (Bảng 4.2), hãy dự đoán lithium là kim loại, phi kim hay khí hiếm?
Bài tập
Câu 1: Trong các cách biểu diễn electron vào các orbital của phần lớp 2p ở trạng thái cơ bản, hãy chọn cách phân bố đúng

Câu 2: Cho nguyên tố X có 2 lớp eletron, lớp thứ 2 có 6 electron. Xác định số hiệu nguyên tử của X
Câu 3: Ở trạng thái cơ bản, nguyên tủ của những nguyên tố nào dưới đây có electron độc thân?
a) Boron
b) Oxygen
c) Phosphorus
d) Chlorine
Câu 4: Viết cấu hình electron nguyên tử của các nguyên tố: carbon ( Z=6), sodium (Z=11) và oxygen (Z=8). Cho biết số electron lớp ngoài cùng trong nguyên tửu các các nguyên tố trên. Chúng là kim loại, phi kim hay khí hiếm?
Giải bài tập sách giáo khoa (SGK) 10 Kết nối tri thức
- Soạn văn lớp 10 tập 1 kết nối tri thức
- Soạn văn lớp 10 tập 2 kết nối tri thức
- Văn mẫu lớp 10 kết nối tri thức
- Giải bài tập toán lớp 10 tập 1 kết nối tri thức
- Giải bài tập toán lớp 10 tập 2 kết nối tri thức
- Giải bài tập vật lí lớp 10 kết nối tri thức
- Giải bài tập hóa học lớp 10 kết nối tri thức
- Giải bài tập sinh học lớp 10 kết nối tri thức
- Giải bài tập Địa lí lớp 10 kết nối tri thức
- Giải bài tập lịch sử lớp 10 kết nối tri thức
- Giải bài tập tin học lớp 10 kết nối tri thức
- Giải bài tập Âm nhạc lớp 10 kết nối tri thức
- Giải bài tập mĩ thuật lớp 10 kết nối tri thức
- Giải bài tập giáo dục kinh tế pháp luật lớp 10 kết nối tri thức
- Giải bài tập giáo dục quốc phòng an ninh lớp 10 kết nối tri thức
- Giải bài tập hoạt động trải nghiệm lớp 10 kết nối tri thức
- Giải bài tập thiết kế công nghệ lớp 10 kết nối tri thức
- Giải bài tập công nghệ trồng trọt lớp 10 kết nối tri thức
- Giải bài tập giáo dục thể chất lớp 10 kết nối tri thức
- Giải bài tập tiếng anh lớp 10 Global Success
Giải bài tập sách giáo khoa (SGK) 10 Chân trời sáng tạo
- Soạn văn lớp 10 tập 1 chân trời sáng tạo
- Soạn văn lớp 10 tập 2 chân trời sáng tạo
- Văn mẫu lớp 10 chân trời sáng tạo
- Giải bài tập toán lớp 10 tập 1 chân trời sáng tạo
- Giải bài tập toán lớp 10 tập 2 chân trời sáng tạo
- Giải bài tập vật lí lớp 10 chân trời sáng tạo
- Giải bài tập hóa học lớp 10 chân trời sáng tạo
- Giải bài tập sinh học lớp 10 chân trời sáng tạo
- Giải bài tập Địa lí lớp 10 chân trời sáng tạo
- Giải bài tập lịch sử lớp 10 chân trời sáng tạo
- Giải bài tập tin học lớp 10 chân trời sáng tạo
- Giải bài tập Âm nhạc lớp 10 chân trời sáng tạo
- Giải bài tập mĩ thuật lớp 10 chân trời sáng tạo
- Giải bài tập giáo dục kinh tế pháp luật lớp 10 chân trời sáng tạo
- Giải bài tập Hoạt động trải nghiệm, hướng nghiệp lớp 10 chân trời sáng tạo bản 1
- Giải bài tập Hoạt động trải nghiệm, hướng nghiệp lớp 10 chân trời sáng tạo bản 2
- Giải bài tập giáo dục quốc phòng an ninh lớp 10 chân trời sáng tạo
- Giải bài tập thiết kế công nghệ lớp 10 chân trời sáng tạo
- Giải bài tập công nghệ trồng trọt lớp 10 chân trời sáng tạo
- Giải bài tập giáo dục thể chất lớp 10 chân trời sáng tạo
- Giải bài tập tiếng anh lớp 10 Friends Global
Giải bài tập sách giáo khoa (SGK) 10 Cánh diều
- Soạn văn lớp 10 tập 1 cánh diều
- Soạn văn lớp 10 tập 2 cánh diều
- Văn mẫu lớp 10 cánh diều
- Giải bài tập toán lớp 10 tập 1 cánh diều
- Giải bài tập toán lớp 10 tập 2 cánh diều
- Giải bài tập vật lí lớp 10 cánh diều
- Giải bài tập hóa học lớp 10 cánh diều
- Giải bài tập sinh học lớp 10 cánh diều
- Giải bài tập Địa lí lớp 10 cánh diều
- Giải bài tập lịch sử lớp 10 cánh diều
- Giải bài tập tin học lớp 10 cánh diều
- Giải bài tập Âm nhạc lớp 10 cánh diều
- Giải bài tập mĩ thuật lớp 10 cánh diều
- Giải bài tập giáo dục kinh tế pháp luật lớp 10 cánh diều
- Giải bài tập giáo dục quốc phòng an ninh lớp 10 cánh diều
- Giải bài tập hoạt động trải nghiệm lớp 10 cánh diều
- Giải bài tập thiết kế công nghệ lớp 10 cánh diều
- Giải bài tập công nghệ trồng trọt lớp 10 cánh diều
- Giải bài tập giáo dục thể chất lớp 10 cánh diều
- Giải bài tập tiếng anh lớp 10 Explore new worlds
Giải bài tập sách bài tập (SBT) lớp 10 kết nối tri thức
- Giải bài tập sách bài tập (SBT) ngữ văn lớp 10 tập 1 kết nối tri thức
- Giải bài tập sách bài tập (SBT) ngữ văn lớp 10 tập 2 kết nối tri thức
- Giải bài tập sách bài tập (SBT) toán lớp 10 tập 1 kết nối tri thức
- Giải bài tập sách bài tập (SBT) toán lớp 10 tập 2 kết nối tri thức
- Giải bài tập sách bài tập (SBT) hóa học lớp 10 kết nối tri thức
- Giải bài tập sách bài tập (SBT) sinh học lớp 10 kết nối tri thức
- Giải bài tập sách bài tập (SBT) vật lí lớp 10 kết nối tri thức
- Giải bài tập sách bài tập (SBT) lịch sử lớp 10 kết nối tri thức
- Giải bài tập sách bài tập (SBT) địa lí lớp 10 kết nối tri thức
- Giải bài tập sách bài tập (SBT) tin học lớp 10 kết nối tri thức
- Giải bài tập sách bài tập (SBT) giáo dục kinh tế pháp luật lớp 10 kết nối tri thức
- Giải bài tập sách bài tập (SBT) giáo dục quốc phòng và an ninh lớp 10 kết nối tri thức
- Giải bài tập sách bài tập (SBT) hoạt động trải nghiệm lớp 10 kết nối tri thức
- Giải bài tập sách bài tập (SBT) tiếng anh lớp 10 Global success
Giải bài tập sách bài tập (SBT) lớp 10 chân trời sáng tạo
- Giải bài tập sách bài tập (SBT) ngữ văn lớp 10 tập 1 chân trời sáng tạo
- Giải bài tập sách bài tập (SBT) ngữ văn lớp 10 tập 2 chân trời sáng tạo
- Giải bài tập sách bài tập (SBT) toán lớp 10 tập 1 chân trời sáng tạo
- Giải bài tập sách bài tập (SBT) toán lớp 10 tập 2 chân trời sáng tạo
- Giải bài tập sách bài tập (SBT) hóa học lớp 10 chân trời sáng tạo
- Giải bài tập sách bài tập (SBT) sinh học lớp 10 chân trời sáng tạo
- Giải bài tập sách bài tập (SBT) vật lí lớp 10 chân trời sáng tạo
- Giải bài tập sách bài tập (SBT) lịch sử lớp 10 chân trời sáng tạo
- Giải bài tập sách bài tập (SBT) địa lí lớp 10 chân trời sáng tạo
- Giải bài tập sách bài tập (SBT) giáo dục kinh tế pháp luật lớp 10 chân trời sáng tạo
- Giải bài tập sách bài tập (SBT) giáo dục quốc phòng và an ninh lớp 10 chân trời sáng tạo
- Giải bài tập sách bài tập (SBT) hoạt động trải nghiệm lớp 10 chân trời sáng tạo bản 1
- Giải bài tập sách bài tập (SBT) hoạt động trải nghiệm lớp 10 chân trời sáng tạo bản 2
- Giải bài tập sách bài tập (SBT) tiếng anh lớp 10 Friends Global
Giải bài tập sách bài tập (SBT) lớp 10 Cánh diều
- Giải bài tập sách bài tập (SBT) ngữ văn lớp 10 tập 1 cánh diều
- Giải bài tập sách bài tập (SBT) ngữ văn lớp 10 tập 2 cánh diều
- Giải bài tập sách bài tập (SBT) toán lớp 10 tập 1 cánh diều
- Giải bài tập sách bài tập (SBT) toán lớp 10 tập 2 cánh diều
- Giải bài tập sách bài tập (SBT) hóa học lớp 10 cánh diều
- Giải bài tập sách bài tập (SBT) sinh học lớp 10 cánh diều
- Giải bài tập sách bài tập (SBT) vật lí lớp 10 cánh diều
- Giải bài tập sách bài tập (SBT) lịch sử lớp 10 cánh diều
- Giải bài tập sách bài tập (SBT) địa lí lớp 10 cánh diều
- Giải bài tập sách bài tập (SBT) tin học lớp 10 cánh diều
- Giải bài tập sách bài tập (SBT) giáo dục kinh tế pháp luật lớp 10 cánh diều
- Giải bài tập sách bài tập (SBT) hoạt động trải nghiệm lớp 10 cánh diều
- Giải bài tập sách bài tập (SBT) giáo dục quốc phòng và an ninh lớp 10 cánh diều
- Giải bài tập sách bài tập (SBT) tiếng anh lớp 10 Explore new world
Giải bài tập chuyên đề học tập 10 Kết nối tri thức
- Giải bài tập chuyên đề toán lớp 10 kết nối tri thức
- Giải bài tập chuyên đề ngữ văn lớp 10 kết nối tri thức
- Giải bài tập chuyên đề vật lí lớp 10 kết nối tri thức
- Giải bài tập chuyên đề hóa học lớp 10 kết nối tri thức
- Giải bài tập chuyên đề sinh học lớp 10 kết nối tri thức
- Giải bài tập chuyên đề lịch sử lớp 10 kết nối tri thức
- Giải bài tập chuyên đề địa lí lớp 10 kết nối tri thức
- Giải bài tập chuyên đề công nghệ trồng trọt lớp 10 kết nối tri thức
- Giải bài tập chuyên đề giáo dục kinh tế và pháp luật lớp 10 kết nối tri thức
- Giải bài tập chuyên đề tin học lớp 10 theo định hướng tin học ứng dụng kết nối tri thức
- Giải bài tập chuyên đề tin học lớp 10 theo định hướng khoa học máy tính kết nối tri thức
- Giải bài tập chuyên đề mĩ thuật lớp 10 kết nối tri thức
Giải bài tập chuyên đề học tập 10 Chân trời sáng tạo
- Giải bài tập chuyên đề toán lớp 10 chân trời sáng tạo
- Giải bài tập chuyên đề ngữ văn lớp 10 chân trời sáng tạo
- Giải bài tập chuyên đề vật lí lớp 10 chân trời sáng tạo
- Giải bài tập chuyên đề hóa học lớp 10 chân trời sáng tạo
- Giải bài tập chuyên đề sinh học lớp 10 chân trời sáng tạo
- Giải bài tập chuyên đề địa lí lớp 10 chân trời sáng tạo
- Giải bài tập chuyên đề lịch sử lớp 10 chân trời sáng tạo
- Giải bài tập chuyên đề giáo dục kinh tế và pháp luật lớp 10 chân trời sáng tạo
- Giải bài tập chuyên đề âm nhạc lớp 10 chân trời sáng tạo
Giải bài tập chuyên đề học tập 10 Cánh diều
- Giải bài tập chuyên đề toán lớp 10 cánh diều
- Giải bài tập chuyên đề ngữ văn lớp 10 cánh diều
- Giải bài tập chuyên đề vật lí lớp 10 cánh diều
- Giải bài tập chuyên đề hóa học lớp 10 cánh diều
- Giải bài tập chuyên đề sinh học lớp 10 cánh diều
- Giải bài tập chuyên đề địa lí lớp 10 cánh diều
- Giải bài tập chuyên đề lịch sử lớp 10 cánh diều
- Giải bài tập chuyên đề công nghệ trồng trọt lớp 10 cánh diều
- Giải bài tập chuyên đề giáo dục kinh tế và pháp luật lớp 10 cánh diều
- Giải bài tập chuyên đề tin học lớp 10 theo định hướng tin học ứng dụng cánh diều
- Giải bài tập chuyên đề tin học lớp 10 theo định hướng khoa học máy tính cánh diều
- Giải bài tập chuyên đề âm nhạc lớp 10 cánh diều




