Giải bài tập 10 Liên kết cộng hóa trị
Giải bài tập 10: Liên kết cộng hóa trị - Sách Hóa học lớp 10
Trong chương này, chúng ta sẽ tìm hiểu về sự hình thành liên kết cộng hóa trị, một khái niệm quan trọng trong hóa học. Khi các nguyên tử tham gia hình thành liên kết, chúng có xu hướng tạo thành lớp vỏ ngoài cùng tương ứng với khí hiếm gần nhất. Ví dụ, trong phân tử HCl, nguyên tử H và Cl góp chung electron để tạo lớp vỏ tương ứng với khí hiếm He, Ar. Tương tự, trong phân tử O2, mỗi nguyên tử O góp chung 2 electron để tạo lớp vỏ tương ứng với khí hiếm Ne. Trên cơ sở này, chúng ta có thể hiểu hơn về cấu trúc và tính chất của các phân tử hóa học.
Bài tập và hướng dẫn giải
Câu 3: Thế nào là liên kết đơn, liên kết đôi và liên kết ba?
Câu hỏi bổ sung 1: Hai nguyên tử Cl mỗi nguyên tử góp chung 1 electron tạo thành một cặp electron dùng chung và liên kết cộng hóa trị trong phân tử Cl2 là liên kết được hình thành giữa hai nguyên tử Cl bằng một cặp electron dùng chung đó.
Câu 4: Viết công thức electron, công thức Lewwis và công thức cấu tạo của Cl 2 , H 2 O, CH 4
Câu hỏi bố sung 2: Trình bày sự hình thành liên kết cộng hóa trị trong phân
2. Liên kết cho- nhận
Câu 5: Biết phân tử CO cũng có liên kết cho- nhận. Viết công thức electron và công thức cấu tạo của CO
Câu 6: Cho biết đặc điểm của nguyên tử "cho" và nguyên tử "nhận" trong phân tử liên kết cho- nhận
Câu hỏi bổ sung: Trình bày liên kết cho- nhận trong ion NH 4+
3. Phân biệt các loại liên kết dựa theo độ âm điện
Phân biệt liên kết cộng hóa trị phân cực và không phân cực
Câu 7: Vì sao liên kết cộng hóa trị trong các phân tử Cl 2, O 2, N 2 là liên kết cộng hóa trị không phân cực?
Câu 8: Trong các phân tử HCl, NH3 và CO2, cặp electron chung lệch về phía nguyên tử nào? Giải thích
Câu hỏi bổ sung: Nêu thêm ví dụ về phân tử có liên kết cộng hóa trị không phân cực và liên kết cộng hóa trị phân cực. Viết công thức electron của chúng để minh họa
Phân biệt loại liên kết trong phân tử dựa trên giá trị hiệu độ âm điện
Câu 9: Liên kết cộng hóa trị trong phân tử dạng A 2 luôn là liên kết cộng hóa trị phân cực hay không phân cực? Giải thích
Câu 10: Em có nhận xét gì khi cặp electron chung trong liên kết lệch hẳn về phía một nguyên tử?
Câu hỏi bổ sung: Cho biết loại liên kết trong các phân tử MgCl2, CO2, C2H4?
4. Sự hình thành liên kết σ, π và năng lượng liên kết
Tìm hiểu sự hình thành liên kết σ và liên kết π
Câu 11: Quan sát các hình từ 10.5 đến 10.8 cho biết liên kết nào trong mỗi phân tử được tạo thành bởi sự xen phủ trục hoặc xen phủ bên của các orbital
Câu 12: Mô tả sự hình thành liên kết σ
Câu 13: Mô tả sự hình thành liên kết π
Câu 14: Quan sát hình 10.8, hãy so sánh sự hình thành liên kết σ và liên kết π
Câu 15: Theo em thế nào là liên kết nội? Phân tử nào dưới đây có chưa liên kết bội Cl 2, HCl, O 2 và N 2?
Câu 16: Sự xen phủ có sự tham gia của orbital nào luôn là xen phủ trục?
Câu 17: Số liên kết σ và liên kết π trong mỗi liên kết đơn, liên kết đôi và liên kết va lần lượt bằng bao nhiêu?
Tìm hiểu khái niệm năng lượng liên kết
Câu hỏi bổ sung: Vẽ sơ đồ xen phủ orbital giữa 2 nguyên tử carbon hình thành liên kết đôi trong phân tử ethlene (C 2 H 4)
Câu 18: Căn cứ giá trị năng lượng liên kết H-H và N≡N đã cho liên kết trong phân tử nào dễ bị phá vỡ?
Câu 19: Theo em vì sao năng lượng liên kết luôn có giá trị dương
Bài tập
Bài 1: Trong phân tử iodine (I2), mỗi nguyên tử idonine đã góp một electron để tạo cặp electron chung. Nhờ đó, mỗi nguyên tử iodine đã đạt cấu hình electron bền vững của khí hiếm nào dưới đây?
A. Xe B. Ne C. Ar D. Kr
Bài 2: Hydrogen sulfide (H2S) và phosphine (PH3) đều là những chất có mũi khó ngửi và rất độc. Trình bày sự tạo thành liên kết cộng hóa trị trong phân tử các chất trên.
Bài 2: Hydrogen sulfide (H2S) và phosphine (PH3) đều là những chất có mũi khó ngửi và rất độc. Trình bày sự tạo thành liên kết cộng hóa trị trong phân tử các chất trên.
Bài 3: Viết công thức Lewis của các phân tử CS2, SCl2 và CCl4
Bài 4: Trình bày sự hình thành liên kết cho - nhận trong phân tử sulful dioxide (SO2)
Bài 7: Cho biết số liên kết σ và liên kết π trong phân tử acetylene (C2H2)
Bài 8: Năng lượng liên kết của các hydrogen halide được liệt kê trong bảng sau:
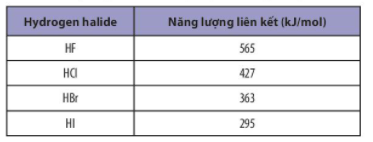
Sắp xếp theo chiều tăng dần độ bền liên kết trong các phân tử HF, HCl, HBr và HI





