Giải bài tập 13 Enthalpy tạo thành và biến thiên Emthalpy của phản ứng hóa học
Giải bài tập 13 Enthalpy tạo thành và biến thiên Enthalpy của phản ứng hóa học
Trong sách hóa học lớp 10 chân trời sáng tạo, bài tập 13 nói về Enthalpy tạo thành và biến thiên Enthalpy của phản ứng hóa học. Bài tập cung cấp các phương trình hóa học và yêu cầu học sinh viết phương trình hóa học và nêu nhận xét về sự thay đổi nhiệt của phản ứng đó.
Ví dụ như câu hỏi đầu tiên yêu cầu viết phương trình hóa học của phản ứng nhiệt nhôm: 2Al + Fe2O3 => Al2O3 + 2Fe. Phản ứng này tỏa nhiệt rất lớn (trên 2500oC), điều này nhấn mạnh sự quan trọng của biến thiên nhiệt trong các phản ứng hóa học.
Bài tập tiếp theo yêu cầu học sinh thực hiện thí nghiệm 1 và rút ra kết luận về sự thay đổi nhiệt độ chất lỏng trong cốc. Thí nghiệm này giúp học sinh hiểu rõ hơn về sự phát ra nhiệt trong các phản ứng hóa học và cách đo lường nhiệt độ này.
Cuối cùng, bài tập đặt thêm câu hỏi bổ sung về sự tăng nhiệt độ môi trường xung quanh khi đốt cháy than, ethanol trong không khí. Điều này giúp học sinh áp dụng kiến thức từ bài học vào thực tế và hiểu rõ hơn về các hiện tượng nhiệt trong cuộc sống hàng ngày.
Bài tập và hướng dẫn giải
Câu hỏi bổ sung: Hãy nêu hiện tượng của các quá trình: đốt cháy than, ethanol trong không khí. Nhiệt độ môi trường xung quanh thay đổi như thế nào?
2. Phản ứng thu nhiệt
Câu 3: Khi thả viên vitamin C sủi vào cốc nước như hình 13.3, em hãy dự đoan sự thay đổi nhiệt độ trong cốc
Câu 4: Trong phản ứng nung đá vôi (CaCO3), nếu ngừng cung cấp nhiệt, phản ứng có tiếp tục xảy ra không?
Câu 5: Thực hành thí nghiệm 2. Nêu hiện tượng trước và sau khi đốt nóng hỗn hợp. Nếu ngừng đốt nóng thì phản ứng có xảy ra không?
3. Biến thiên enthalipy chuẩn của phản ứng
Câu 6: Biến thiên enthalipy chuẩn của một phản ứng hóa học được xác định trong điều kiện nào?
Câu 7: Phương trình nhiệt hóa học cho biết thông tin gì về phản ứng hóa học?
Câu hỏi bổ sung: Cho hai phương trình nhiệt hóa học sau:

Trong hai phản ứng trên, phản ứng nào thu nhiệt, phản ứng nào tỏa nhiệt?
4. Enthalpy tạo thành ( nhiệt tạo thành)
Câu 8: Phân biệt enthalpy tạo thành của một chất và biến thiên enthalpy của phản ứng. Lấy ví dụ minh họa.
Câu 9: Cho phản ứng sau:
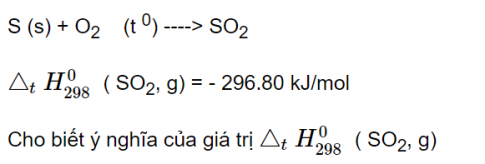
Câu 10: Hợp chất ( SO 2, g) bền hơn hay kém hơn về mặt năng lượng so với các đơn chất bền S(s) và O 2 (g)
Câu 11: Từ bảng 13.1 hãy liệt kê các phản ứng có enthalpy tạo thành dương (lấy nhiệt từ môi trường)
Câu 11: Từ bảng 13.1 hãy liệt kê các phản ứng có enthalpy tạo thành dương (lấy nhiệt từ môi trường)
Câu hỏi bổ sung: Em hãy xác định enthalpy tạo thành theo đơn vị (kcal) của các chất sau:
Fe2 O3 (s), NO (g), H2 O (g), C2H5OH (l)
Cho viết 1 J= 0.239 cal
5. Ý nghĩa của dấu và giá trị của △t H0298
Câu 14: Cho hai phương trình nhiệt hóa học sau:

So sánh nhiệt giữa hai phản ứng (1), (2). Phản ứng nào xảy ra thuận lợi hơn?
Bài tập
Câu 1: Phương trình nhiệt hóa học giữa nitrogen và oxygen như sau:
N2 (g) + O2 (g) --------> 2NO (g)
\bigtriangleup _{t} H_{298}^{0} = + 180 kJ
Kết luận nào sau đây đúng?
A. Nitrogen và oxygen phản ứng mạnh hơn khi ở nhiệt độ thấp
B. Phản ứng tỏa nhiệt
C. Phản ứng xảy ra thuận lợi ở điều kiện thường
D. Phản ứng hóa học xảy ra có sự hấp thụ nhiệt năng từ môi trường
Câu 2: Biến thiên enthalpy của một phản ứng được ghi ở sơ đồ dưới. Kết luận nào sau đây là đúng?
A. Phản ứng tỏa nhiệt
B. Năng lượng chất tham gia phản ứng nhỏ hơn năng lượng sản phẩm
C. Biến thiên enthalpy của phản ứng là a kJ/mol
D. Phản ứng thu nhiệt
Câu 4: Cho phương trình nhiệt hóa học sau:
NaOH (aq) + HCl (aq) -----> NaCl (aq) + H2O (l)
△t$H_{298}^{0}$= -57,3 kJ
Vẽ sơ đồ biểu diễn biến thiên enthalpy của phản ứng





