BÀI MỞ ĐẦU
CHỦ ĐỀ 1: PHẢN ỨNG HÓA HỌC
- Giải bài tập KHTN 8 cánh diều bài 1 Biến đổi vật lí và biến đổi hóa học
- Giải bài tập KHTN 8 cánh diều bài 2 Phản ứng hóa học và năng lượng của phản ứng hóa học
- Giải bài tập KHTN 8 cánh diều bài 3 Định luật bảo toàn khối lượng. Phương trình hoá học
- Giải bài tập KHTN 8 cánh diều bài 4 Mol và tỉ khối của chất khí
- Giải bài tập KHTN 8 cánh diều bài 5 Tính theo phương trình hóa học
- Giải bài tập KHTN 8 cánh diều bài 6 Nồng độ dung dịch
- Giải bài tập KHTN 8 cánh diều bài 7 Tốc độ phản ứng và chất xúc tác
- Giải bài tập KHTN 8 cánh diều Bài tập Chủ đề 1
CHỦ ĐỀ 2: ACID - BASE - pH - OXIDE - MUỐI
- Giải bài tập KHTN 8 cánh diều bài Bài 8 Acid
- Giải bài tập KHTN 8 cánh diều bài 9 Base
- Giải bài tập KHTN 8 cánh diều bài Bài 10 Thang pH
- Giải bài tập KHTN 8 cánh diều bài Bài 11 Oxide
- Giải bài tập KHTN 8 cánh diều bài 12 Muối
- Giải bài tập KHTN 8 cánh diều bài 13 Phân bón hoá học
- Giải bài tập KHTN 8 cánh diều Bài tập Chủ đề 2
CHỦ ĐỀ 3: KHỐI LƯỢNG RIÊNG VÀ ÁP SUẤT
CHỦ ĐỀ 4: TÁC DỤNG LÀM QUAY CỦA LỰC
CHỦ ĐỀ 5: ĐIỆN
CHỦ ĐỀ 6: NHIỆT
CHỦ ĐỀ 7: CƠ THỂ NGƯỜI
- Giải bài tập KHTN 8 cánh diều bài 27 Khái quát về cơ thể người
- Giải bài tập KHTN 8 cánh diều bài 28 Hệ vận động ở người
- Giải bài tập KHTN 8 cánh diều bài 29 Dinh dưỡng và tiêu hoá ở người
- Giải bài tập KHTN 8 cánh diều bài 30 Máu và hệ tuần hoàn ở người
- Giải bài tập KHTN 8 cánh diều bài 31 Thực hành về máu về hệ tuần hoàn
- Giải bài tập KHTN 8 cánh diều bài 32 Hệ hô hấp ở người
- Giải bài tập KHTN 8 cánh diều bài 33 Môi trường trong cơ thể và hệ bài tiết ở người
- Giải bài tập KHTN 8 cánh diều bài 34 Hệ thần kinh và các giác quan ở người
- Giải bài tập KHTN 8 cánh diều bài 35 Hệ nội tiết ở người
- Giải bài tập KHTN 8 cánh diều bài 36 Da và điều hòa thân nhiệt ở người
- Giải bài tập KHTN 8 cánh diều bài 37 Sinh sản ở người
- Giải bài tập KHTN 8 cánh diều Bài tập Chủ đề 7
CHỦ ĐỀ 8: SINH THÁI
- Giải bài tập KHTN 8 cánh diều bài 38 Môi trường và các nhân tố sinh thái
- Giải bài tập KHTN 8 cánh diều bài 39 Quần thể sinh vật
- Giải bài tập KHTN 8 cánh diều bài 40 Quần xã sinh vật
- Giải bài tập KHTN 8 cánh diều bài 41 Hệ sinh thái
- Giải bài tập KHTN 8 cánh diều bài 42 Cân bằng tự nhiên và bảo vệ môi trường
Giải bài tập KHTN 8 cánh diều bài 3 Định luật bảo toàn khối lượng. Phương trình hoá học
https://s.shopee.vn/AKN2JyAJAw
Giải bài tập KHTN 8 cánh diều - Bài 3: Định luật bảo toàn khối lượng
Trong sách khoa học tự nhiên lớp 8 cánh diều, bài tập 3 với chủ đề Định luật bảo toàn khối lượng là một phần quan trọng trong chương trình học. Phương trình hoá học được giải chi tiết và cụ thể, cung cấp đáp án chuẩn và hướng dẫn giải cho từng bài tập. Đây là cơ hội để học sinh nắm vững kiến thức bài học và hiểu rõ hơn về định luật bảo toàn khối lượng.
Hi vọng rằng, qua việc giải bài tập này, các em học sinh sẽ có được sự thấu hiểu và ứng dụng linh hoạt kiến thức vào thực tế. Đồng thời, tự tin hơn trong việc học và rèn luyện kỹ năng giải quyết vấn đề.
Bài tập và hướng dẫn giải
KHỞI ĐỘNG
Câu hỏi: Quan sát hình 3.1

Đặt hai cây nến trên đĩa cân cân ở vị trí thăng bằng. Nếu đốt cháy một cây nến, sau một thời gian, cân có cân bằng không? Giải thích.
I. ĐỊNH LUẬT BẢO TOÀN KHỐI LƯỢNG
Luyện tập 1: Tính khối lượng của FeS tạo thành trong phản ứng của Fe và S, biết khối lượng của Fe và S đã tham gia phản ứng lần lượt là 7 gam và 4 gam.
Vận dụng 1: Trở lại thí nghiệm ở hoạt động mở đầu cân còn giữ được vị trí thăng bằng hay không? Giải thích
II. ÁP DỤNG ĐỊNH LUẬT BẢO TOÀN KHỐI LƯỢNG
Vận dụng 2: Giải quyết tình huống:
a) Khi đốt cháy hoàn toàn một mẩu gỗ ta thu được cho và khối lượng nhẹ hơn mẩu gỗ ban đầu. Theo em, sự thay đổi khối lượng này có mâu thuẫn với định luật bảo toàn khối lượng không?
b) Đề xuất các bước tiến hành thí nghiệm để kiểm chứng định luật bảo toàn khối lượng trong tế bào chết trong tình huống trên.
III. PHƯƠNG TRÌNH HOÁ HỌC
Câu hỏi 1. Dựa vào kiến thức đã học, cho biết tổng số nguyên tử của mỗi nguyên tố tham gia và tạo thành sản phẩm trong ví dụ bên cần phải tuân theo nguyên tắc nào?
Câu hỏi 2. Trong cho biết số nguyên tử của mỗi nguyên tố trong các chất tham gia phản ứng và các chất sản phẩm trong các ô trống bên hình 3.3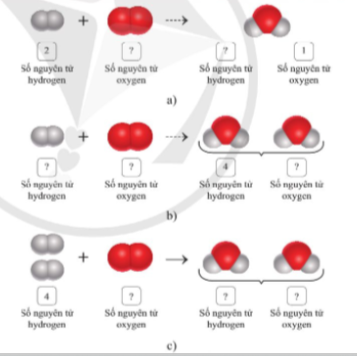
2. Các bước lập phương trình hoá học
Luyện tập 2: Lập phương trình hoá học của phản ứng magnesium (Mg) tác dụng với oxygen (O2) tạo thành magnesium oxitde (MgO)
Luyện tập 3: Lập phương trình hoá học của phản ứng khi cho dung dịch sodium carbonate (Na2CO3) tác dụng với dung dịch calcium hydroxide (Ca(OH)2) tạo thành calcium carbonate (CaCO3) không tan (kết tủa) và sodium hydroxide (NaOH).
Luyện tập 4: Xét phương trình hoá học của phản ứng sau:
4Al + 3O2 → Al2O3
a) Cho biết số nguyên tử, số phân tử các chất tham gia phản ứng và các chất sản phẩm.
b) Cho biết tỉ lệ hệ số của các chất trong phương trình hoá học.
Vận dụng 3: Trong dạ dày người có một lượng hydrochioric acid (HCl) tương đối ổn định, có tác dụng trong tiêu hoá thức ăn. Nếu lượng acid này tăng lên quá mức cần thiết có thể gây ra đau dạ dày. Thuốc muối có thành phần chính là sodium hydrogencarbonate (NaHCO3) giúp giảm bớt lượng acid dư thừa trong dạ dày theo phương trình hoá học:
NaHCO3 + HCl → NaCl + CO2↑ + H2O
Tìm hiểu và cho biết các thực phẩm có thể gây tăng lượng acid có trong dạ dày.
Giải bài tập sách giáo khoa (SGK) lớp 8 kết nối tri thức
- Soạn văn lớp 8 kết nối tri thức
- Soạn văn lớp 8 tập 1 kết nối tri thức
- Soạn văn lớp 8 tập 2 kết nối tri thức
- Giải bài tập toán lớp 8 kết nối tri thức
- Giải bài tập toán lớp 8 tập 1 kết nối tri thức
- Giải bài tập toán lớp 8 tập 2 kết nối tri thức
- Giải bài tập khoa học tự nhiên lớp 8 kết nối tri thức
- Giải bài tập hóa học lớp 8 kết nối tri thức
- Giải bài tập vật lí lớp 8 kết nối tri thức
- Giải bài tập sinh học lớp 8 kết nối tri thức
- Giải bài tập lịch sử và địa lí lớp 8 kết nối tri thức
- Giải bài tập công dân lớp 8 kết nối tri thức
- Giải bài tập công nghệ lớp 8 kết nối tri thức
- Giải bài tập tin học lớp 8 kết nối tri thức
- Giải bài tập mĩ thuật lớp 8 kết nối tri thức
- Giải bài tập âm nhạc lớp 8 kết nối tri thức
- Giải bài tập hoạt động trải nghiệm lớp 8 kết nối tri thức
Giải bài tập sách giáo khoa (SGK) lớp 8 chân trời sáng tạo
- Soạn văn lớp 8 chân trời sáng tạo
- Soạn văn lớp 8 tập 1 chân trời sáng tạo
- Soạn văn lớp 8 tập 2 chân trời sáng tạo
- Giải bài tập toán lớp 8 chân trời sáng tạo
- Giải bài tập toán lớp 8 tập 1 chân trời sáng tạo
- Giải bài tập toán lớp 8 tập 2 chân trời sáng tạo
- Giải bài tập lịch sử và địa lí lớp 8 chân trời sáng tạo
- Giải bài tập công dân lớp 8 chân trời sáng tạo
- Giải bài tập công nghệ lớp 8 chân trời sáng tạo
- Giải bài tập tin học lớp 8 chân trời sáng tạo
- Giải bài tập âm nhạc lớp 8 chân trời sáng tạo
- Giải bài tập mĩ thuật lớp 8 chân trời sáng tạo bản 1
- Giải bài tập mĩ thuật lớp 8 chân trời sáng tạo bản 2
- Giải bài tập hoạt động trải nghiệm lớp 8 chân trời sáng tạo bản 1
- Giải bài tập hoạt động trải nghiệm lớp 8 chân trời sáng tạo bản 2
Giải bài tập sách giáo khoa (SGK) lớp 8 cánh diều
- Soạn văn lớp 8 cánh diều
- Soạn văn lớp 8 tập 1 cánh diều
- Soạn văn lớp 8 tập 2 cánh diều
- Giải bài tập toán lớp 8 cánh diều
- Giải bài tập toán lớp 8 tập 1 cánh diều
- Giải bài tập toán lớp 8 tập 2 cánh diều
- Giải bài tập khoa học tự nhiên lớp 8 cánh diều
- Giải bài tập hóa học lớp 8 cánh diều
- Giải bài tập vật lí lớp 8 cánh diều
- Giải bài tập sinh học lớp 8 cánh diều
- Giải bài tập lịch sử và địa lí lớp 8 cánh diều
- Giải bài tập công dân lớp 8 cánh diều
- Giải bài tập công nghệ lớp 8 cánh diều
- Giải bài tập tin học lớp 8 cánh diều
- Giải bài tập mĩ thuật lớp 8 cánh diều
- Giải bài tập âm nhạc lớp 8 cánh diều
- Giải bài tập hoạt động trải nghiệm lớp 8 cánh diều
Giải bài tập sách bài tập (SBT) lớp 8 kết nối tri thức
- Soạn sách bài tập (SBT) ngữ văn lớp 8 kết nối tri thức
- Soạn sách bài tập (SBT) ngữ văn lớp 8 tập 1 kết nối tri thức
- Soạn sách bài tập (SBT) ngữ văn lớp 8 tập 2 kết nối tri thức
- Giải bài tập sách bài tập (SBT) toán lớp 8 kết nối tri thức
- Giải bài tập sách bài tập (SBT) toán lớp 8 tập 1 kết nối tri thức
- Giải bài tập sách bài tập (SBT) toán lớp 8 tập 2 kết nối tri thức
- Giải bài tập sách bài tập (SBT) khoa học tự nhiên lớp 8 kết nối tri thức
- Giải bài tập sách bài tập (SBT) hóa học lớp 8 kết nối tri thức
- Giải bài tập sách bài tập (SBT) vật lí lớp 8 kết nối tri thức
- Giải bài tập sách bài tập (SBT) sinh học lớp 8 kết nối tri thức
- Giải bài tập sách bài tập (SBT) lịch sử và địa lí lớp 8 kết nối tri thức
- Giải bài tập sách bài tập (SBT) công dân lớp 8 kết nối tri thức
- Giải bài tập sách bài tập (SBT) công nghệ lớp 8 kết nối tri thức
- Giải bài tập sách bài tập (SBT) tin học lớp 8 kết nối tri thức
- Giải bài tập sách bài tập (SBT) âm nhạc lớp 8 kết nối tri thức
- Giải bài tập sách bài tập (SBT) mĩ thuật lớp 8 kết nối tri thức
- Giải bài tập sách bài tập (SBT) hoạt động trải nghiệm lớp 8 kết nối tri thức
Giải bài tập sách bài tập (SBT) lớp 8 chân trời sáng tạo
- Soạn sách bài tập (SBT) ngữ văn lớp 8 tập 1 chân trời sáng tạo
- Soạn sách bài tập (SBT) ngữ văn lớp 8 tập 2 chân trời sáng tạo
- Giải bài tập sách bài tập (SBT) toán lớp 8 chân trời sáng tạo
- Giải bài tập sách bài tập (SBT) toán lớp 8 tập 1 chân trời sáng tạo
- Giải bài tập sách bài tập (SBT) toán lớp 8 tập 2 chân trời sáng tạo
- Giải bài tập sách bài tập (SBT) lịch sử và địa lí lớp 8 chân trời sáng tạo
- Giải bài tập sách bài tập (SBT) công dân lớp 8 chân trời sáng tạo
- Giải bài tập sách bài tập (SBT) tin học lớp 8 chân trời sáng tạo
- Giải bài tập sách bài tập (SBT) công nghệ lớp 8 chân trời sáng tạo
- Giải bài tập sách bài tập (SBT) âm nhạc lớp 8 chân trời sáng tạo
- Giải bài tập sách bài tập (SBT) mĩ thuật lớp 8 chân trời sáng tạo bản 1
- Giải bài tập sách bài tập (SBT) mĩ thuật lớp 8 chân trời sáng tạo bản 2
- Giải bài tập sách bài tập (SBT) hoạt động trải nghiệm lớp 8 chân trời sáng tạo bản 1
- Giải bài tập sách bài tập (SBT) hoạt động trải nghiệm lớp 8 chân trời sáng tạo bản 2
Soạn sách bài tập (SBT) lớp 8 cánh diều
- Soạn sách bài tập (SBT) ngữ văn lớp 8 tập 1 cánh diều
- Soạn sách bài tập (SBT) ngữ văn lớp 8 tập 2 cánh diều
- Giải bài tập sách bài tập (SBT) toán lớp 8 cánh diều
- Giải bài tập sách bài tập (SBT) toán lớp 8 tập 1 cánh diều
- Giải bài tập sách bài tập (SBT) toán lớp 8 tập 2 cánh diều
- Giải bài tập sách bài tập (SBT) khoa học tự nhiên lớp 8 cánh diều
- Giải bài tập sách bài tập (SBT) hóa học lớp 8 cánh diều
- Giải bài tập sách bài tập (SBT) vật lí lớp 8 cánh diều
- Giải bài tập sách bài tập (SBT) sinh học lớp 8 cánh diều
- Giải bài tập sách bài tập (SBT) lịch sử và địa lí lớp 8 cánh diều
- Giải bài tập sách bài tập (SBT) công dân lớp 8 cánh diều
- Giải bài tập sách bài tập (SBT) công nghệ lớp 8 cánh diều
- Giải bài tập sách bài tập (SBT) tin học lớp 8 cánh diều
- Giải bài tập sách bài tập (SBT) âm nhạc lớp 8 cánh diều
- Giải bài tập sách bài tập (SBT) mĩ thuật lớp 8 cánh diều
- Giải bài tập sách bài tập (SBT) hoạt động trải nghiệm lớp 8 cánh diều




