Giải bài tập Chuyên đề Hoá học 10 Cánh diều bài 10 Tính tham số cấu trúc và năng lượng phân của phân tử
Hướng dẫn giải bài tập chuyên đề Hóa học 10 Cánh diều bài 10
Trong bài học này, chúng ta sẽ tìm hiểu về cách tính toán các tham số cấu trúc và năng lượng phân tử. Bài toán này đưa ra những yêu cầu cụ thể để học sinh có thể áp dụng kiến thức đã học vào thực hành. Sách chuyên đề hóa học lớp 10 Cánh diều đã được biên soạn một cách cụ thể, giúp học sinh hiểu rõ hơn về vấn đề này.
Bộ sách này giúp phát triển năng lực vận dụng tri thức cho học sinh. Hướng dẫn giải chi tiết và cụ thể sẽ giúp học sinh nắm bắt bài học một cách hiệu quả. Hy vọng rằng qua việc học tập theo sách, học sinh sẽ có thêm kiến thức và kỹ năng cần thiết để thành công trong môn hóa học.
Bài tập và hướng dẫn giải
1. Giới thiệu sơ lược về phần mềm tính toán (hóa học lượng tử) và bán kinh nghiệm
2. Cài đặt phần mềm MOPAC
3. Thực hiện tính và hiển thị kết quả
Luyện tập: Tính lại cấu trúc của C6H5OH trong dung môi nước. Các giá trị nhiệt tạo thành, năng lượng tổng, độ dài liên kết O-H và góc liên kết HOC là bao nhiêu?
Bài tập
Bài 1:Sử dụng phương pháp PM7 để xác định đồng phân cis-2-butene hay trans-2-butene bền hơn. Biết rằng, đồng phân có năng lượng tổng âm hơn sẽ bền hơn:

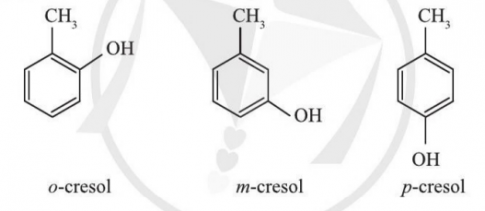
Bài 2: Sử dụng phương pháp PM7 tính cấu trúc (độ dài liên kết, góc liên kết), nhiệt tạo thành, năng lượng tổng của 3 đồng phân o, m, p-cresol. So sánh độ bền giữa các đồng phân.
Bài 3: Cho dãy hợp chất H2X, với X là các nguyên tố nhóm VIA gồm O, S, Se. Sử dụng phương pháp tính PM7 để tối ưu hóa cấu trúc, từ đó tính độ dài liên kết X-H và góc HXH. Tìm quy luật biến đổi các giá trị này trong dãy nêu trên.
Bài 4: Sử dụng phương pháp PM7 để tối ưu hóa cấu trúc, từ đó tính (độ dài liên kết, góc liên kết) các chất có trong các phương trình phản ứng sau:
O2(g) + 2H2(g) → 2H2O(g) (1)
F2(g) + H2(g) → 2HF (g) (2)
a) Tính biến thiên enthalpy của phản ứng (1) và (2) theo phương pháp PM7. So sánh kết quả nhận được với kết quả tính từ enthalpy tạo thành chuẩn của các chất trong Phụ lục 2.
b*) Tính biến thiên năng lượng của phản ứng (1) và (2). Từ đó, so sánh khả năng phản ứng của oxygen và fluorine với hydrogen.
Biết rằng, biến thiên năng lượng của phản ứng cũng được tính giống như biến thiên enthalpy của phản ứng, nhưng thay nhiệt tạo thành bởi năng lượng tổng của phân tử.
Chú ý: Enthalpy tạo thành chuẩn của các đơn chất ở trạng thái bền bằng 0.
Bài 5: Bằng cách tối ưu hóa cấu trúc, hãy xác định độ dài các liên kết H–X (với X là F, Cl, Br, I).





