Giải bài tập Chuyên đề Hoá học 10 chân trời sáng tạo bài 4 Entropy và biến thiên năng lượng tự do Gibbs
Hướng dẫn giải bài tập chuyên đề Hoá học 10: Entropy và biến thiên năng lượng tự do Gibbs
Trong trang 27 của sách chuyên đề Hoá học lớp 10 Chân trời sáng tạo, có hướng dẫn giải bài tập chuyên đề về Entropy và biến thiên năng lượng tự do Gibbs. Bộ sách này đã được biên soạn để giúp các em học sinh phát triển năng lực vận dụng kiến thức một cách hiệu quả. Sự cụ thể và chi tiết trong cách hướng dẫn giải bài tập giúp học sinh dễ dàng nắm vững bài học. Hy vọng rằng thông qua sách này, học sinh sẽ có cơ hội hiểu sâu hơn về chuyên đề này và áp dụng kiến thức vào thực tế một cách linh hoạt.
Bài tập và hướng dẫn giải
1. ENTROPY
Câu hỏi 1. Tại sao khi tăng nhiệt độ lại làm tăng entropy của hệ?
Câu hỏi 2. Khi chuyển thể của chất từ trạng thái rắn sang lỏng và khí thì entropy của chất tăng hay giảm? Giải thích.
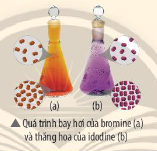
Câu hỏi vận dụng: Quan sát bình đựng Br2 (l) đang bay hơi (a) và bình đựng l2 (s) đang thăng hoa (b) trong hình bên và cho biết các quá trình trên làm tăng hay giảm entropy?Giải thích.
2. BIẾN THIÊN ENTROPY TRONG PHẢN ỨNG HOÁ HỌC
Câu hỏi vận dụng:
Dựa vào số liệu Bảng 4.1, hãy tính biến thiên entropy chuẩn của các phản ứng sau:
a) SO3 (g) → SO2 (g) + $ \frac{1}{2}$ O2 (g) và so sánh giá trị $ \Delta _{r}S_{298}^{o}$ của phản ứng này với phản ứng ở ví dụ 1. Giải thích.
b) C (graphite, s) + O2 (g) → CO2 (g).
Giải thích tại sao giá trị này lại lớn hơn 0 không đáng kể.
3. BIẾN THIÊN NĂNG LƯỢNG TỰ DO GIBBS
Câu hỏi 3. Hoà tan vôi sống (CaO) vào nước, phản ứng toả nhiệt hay thu nhiệt? Dự đoán dấu ∆H của phản ứng.
Câu hỏi vận dụng: Khi cho mẩu nhỏ sodium (Na) vào chậu thuỷ tinh chứa nước, mẩu sodium tan, có bọt khí xuất hiện, làm tăng nhiệt độ của nước trong chậu. Giải thích tại sao phản ứng này lại tự xảy ra một cách dễ dàng.
BÀI TẬP
1. Quan sát hình dưới: Khi trộn nước và propanol (bên trái) thu được dung dịch (bên phải). Hãy cho biết quá trình đó sẽ làm tăng hay giảm entropy.

2. Em hãy dự đoán trong các phản ứng sau, phản ứng nào có ∆S > 0, ∆S < 0 và ∆S = 0. Giải thích.
a) C (s) + CO2 (g) → 2CO (g)
b) CO (g) + $\frac{1}{2}$O2(g) → CO2 (g)
c) H2 (g) + Cl2(g) → 2HCl (g)
d) S (s) + O2 (g) → SO2 (g)
e) Zn (s) + 2HCl (aq) → ZnCl2 (aq) + H2
3. Cho phản ứng hoá học : CO2(g) → CO (g) + $\frac{1}{2}$O2 (g) và các dữ kiện:
| Chất | O2 (g) | CO2 (g) | CO (g) |
| $\Delta _{f}H_{298}^{o}$(kJ/ mol) | 0 | -393,51 | -110,05 |
| $S_{298}^{o}$(J/mol.K) | 205,03 | 213,69 | -197,50 |
a) Ở điều kiện chuẩn phản ứng trên có tự xảy ra được không?
b) Nếu coi ∆rH° và ∆rS° không phụ thuộc vào nhiệt độ, hãy cho biết ở nhiệt độ nào phản ứng trên có thể tự xảy ra ở điều kiện chuẩn?





